El equilibrio químico en una reacción se establece cuando las concentraciones tanto de los reactivos como de los productos permanecen constantes con el tiempo, manteniendo además las condiciones físicas del sistema.
El estudio del equilibrio químico es de vital importancia en la Industria Química, pues permite conocer qué cantidad de producto podemos obtener de una reacción química, y si interesa económicamente, permite además adecuar las condiciones físicas de la reacción para que ésta maximice la producción de un determinado compuesto
El estudio del equilibrio químico es de vital importancia en la Industria Química, pues permite conocer qué cantidad de producto podemos obtener de una reacción química, y si interesa económicamente, permite además adecuar las condiciones físicas de la reacción para que ésta maximice la producción de un determinado compuesto
Ejercicios
"A 448ºC la constante de equilibrio para la reacción de descomposición gaseosa del yoduro de hidrógeno es de 0,02. Inicialmente se introducen en un recipiente de 1L 0,01 moles de hidrógeno y yodo. Calcular las cantidades de reactivos y productos en el equilibrio, y el valor de Kp."
Escribimos primeramente la reacción de descomposición en fase gas:
y a continuación elaboramos la siguiente tabla: iniciales - 0,01 0,01
reaccionan 2x x x
eq. 2x 0,01-x 0,01-x
de tal manera que esos valores los podemos llevar a la expresión matemática de la constante de equilibrio que ya conocemos. Vamos a indicar solo el número de moles de cada sustancia, pues ya nos dicen que el volumen es de 1L:
de tal manera que obtenemos una ecuación de segundo grado, de la que obtenemos dos soluciones:
evidentemente la primera solución no nos sirve, puesto que a la hora de calcular las concentraciones de los productos de descomposición, éstas quedarían negativas, por tanto optaremos por la segunda, y calcularemos así las concentraciones del reactivo y ambos productos:
por último, para calcular Kp a partir de la K ya conocida, debemos fijarnos en la variación del número de moles en la reacción gaseosa:
var. n = moles productos - moles reactivos = 2-2 = 0:
"Cuando se alcanza el equilibrio a 25ºC, en la reacción de esterificación de 180g de ácido acético con 138g de etanol, se obtienen 166g de acetato de etilo, todo ello en un matraz de 2,6L. Calcular la constante de equilibrio de esta reacción."
Traducimos a moles los g de cada sustancia que nos dan:
Escribimos la correspondiente reacción de esterificación ya ajustada:
y elaboramos a correspondiente tabla: iniciales 3 3 -
reaccionan 1,89 1,89 -1,89
eq: 1,11 1,11 1,89
obsérvese que puesto que la reacción es mol a mol, por cada mol de producto obtenido, deben reaccionar el mismo número de moles de ambos reactivos. Nótese también que al ser el agua el medio de reacción, el agua como producto de la reacción no se tendrá en cuenta en los cálculos de K:
"Partiendo de la reacción y solución anteriores, se tienen 180g de ácido acético de los que se quieren obtener 220g de acetato de etilo. Calcular la masa de etanol necesaria."
Traducimos a moles los g de acetato que nos dan, ya que vemos que la cantidad de ácido acético es la misma:
volvemos a plantear la misma reacción con su correspondiente tabla, esta vez con datos diferentes:
iniciales 3 x -
reaccionan 2,5 2,5 -2,5
eq: 0,5 x- 2,5 2,5
sustituimos esos datos en la expresión matemática de K, cuyo valor esta vez conocemos de antemano:
de donde despejamos: x = 5,75 moles etanol, que traduciéndolos a gramos, equivalen a:
y a continuación elaboramos la siguiente tabla: iniciales - 0,01 0,01
reaccionan 2x x x
eq. 2x 0,01-x 0,01-x
de tal manera que esos valores los podemos llevar a la expresión matemática de la constante de equilibrio que ya conocemos. Vamos a indicar solo el número de moles de cada sustancia, pues ya nos dicen que el volumen es de 1L:
de tal manera que obtenemos una ecuación de segundo grado, de la que obtenemos dos soluciones:
evidentemente la primera solución no nos sirve, puesto que a la hora de calcular las concentraciones de los productos de descomposición, éstas quedarían negativas, por tanto optaremos por la segunda, y calcularemos así las concentraciones del reactivo y ambos productos:
Solución:
por último, para calcular Kp a partir de la K ya conocida, debemos fijarnos en la variación del número de moles en la reacción gaseosa:
var. n = moles productos - moles reactivos = 2-2 = 0:
Solución: Kp = K = 0,02
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
"Cuando se alcanza el equilibrio a 25ºC, en la reacción de esterificación de 180g de ácido acético con 138g de etanol, se obtienen 166g de acetato de etilo, todo ello en un matraz de 2,6L. Calcular la constante de equilibrio de esta reacción."
Traducimos a moles los g de cada sustancia que nos dan:
Escribimos la correspondiente reacción de esterificación ya ajustada:
y elaboramos a correspondiente tabla: iniciales 3 3 -
reaccionan 1,89 1,89 -1,89
eq: 1,11 1,11 1,89
obsérvese que puesto que la reacción es mol a mol, por cada mol de producto obtenido, deben reaccionar el mismo número de moles de ambos reactivos. Nótese también que al ser el agua el medio de reacción, el agua como producto de la reacción no se tendrá en cuenta en los cálculos de K:
Solución: K = 4 (a 25ºC)
"Partiendo de la reacción y solución anteriores, se tienen 180g de ácido acético de los que se quieren obtener 220g de acetato de etilo. Calcular la masa de etanol necesaria."
Traducimos a moles los g de acetato que nos dan, ya que vemos que la cantidad de ácido acético es la misma:
volvemos a plantear la misma reacción con su correspondiente tabla, esta vez con datos diferentes:
iniciales 3 x -
reaccionan 2,5 2,5 -2,5
eq: 0,5 x- 2,5 2,5
sustituimos esos datos en la expresión matemática de K, cuyo valor esta vez conocemos de antemano:
de donde despejamos: x = 5,75 moles etanol, que traduciéndolos a gramos, equivalen a:
Solución: 264,5g de etanol
obviamente, si partiendo de una misma cantidad de ácido acético (180g), deseamos obtener mayor cantidad de éster (de 166 a 220g), debemos añadir una mayor cantidad de alcohol (de 138 a 264,5g), puesto que el valor de la constante de equilibrio siempre será el mismo, salvo que se varíe la temperatura.







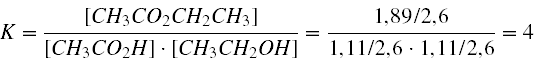


No hay comentarios:
Publicar un comentario